Streszczenie: Nowe badanie sugeruje, że nieprawidłowości w białku SOD1 są częstym czynnikiem we wszystkich typach chorób neuronu ruchowego.
źródło: Uniwersytet w Sydney
Naukowcy odkryli, że nieprawidłowe białko zwykle związane z rzadką, genetycznie zmodyfikowaną postacią choroby neuronu ruchowego występuje we wszystkich rodzajach choroby neuronu ruchowego, co sugeruje wspólny związek między różnymi postaciami choroby.
Badanie zostało opublikowane w Journal of Neuroscience mózgJako pierwszy potwierdził toksyczne zmiany w białku u osób z dziedziczną lub niedziedziczną postacią choroby neuronu ruchowego.
Stwardnienie zanikowe boczne (ALS) jest najczęstszą postacią choroby neuronu ruchowego. Dziesięć procent przypadków ALS jest dziedzicznych, podczas gdy pozostałe przypadki nie mają wyraźnej przyczyny genetycznej.
„Wyniki sugerują, że to nieprawidłowe białko przyczynia się do śmierci komórek w wielu postaciach chorób neuronu ruchowego, a nie tylko w rzadkich genetycznych chorobach neuronu ruchowego” – mówi główny badacz, profesor Kay Doble z Center for Brain and Mind, College of Medicine i Zdrowie.
„To ogromny krok w pogłębianiu naszej wiedzy na temat choroby neuronu ruchowego. Nasze odkrycia pokierują dalszymi badaniami i mogą ostatecznie doprowadzić do bardziej skutecznych metod leczenia”.
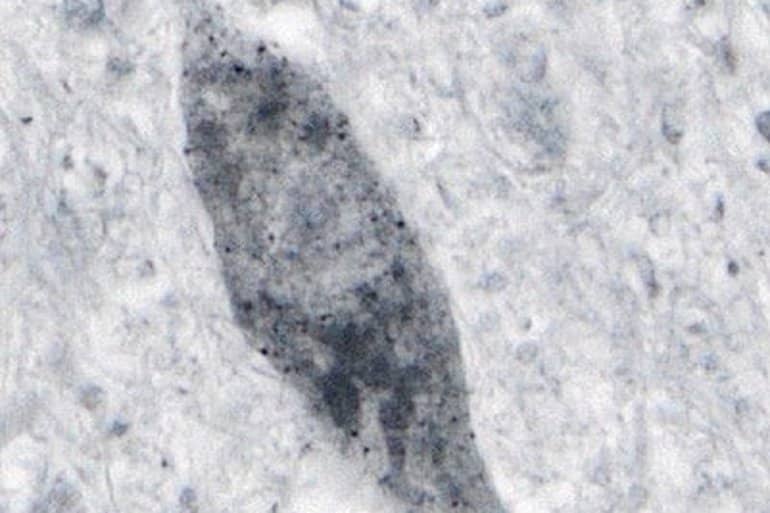
Zwykle białko dysmutaza ponadtlenkowa 1 (SOD1) chroni komórki, ale uważa się, że mutacja w jej genie powoduje, że białko jest „toksyczne”; Ta toksyczna forma białka jest powiązana z genetycznymi formami stwardnienia zanikowego bocznego. Nieprawidłowy mutant SOD1 znajduje się tylko w obszarach rdzenia kręgowego, w których umierają neurony, co wiąże się z tym nieprawidłowym białkiem w śmierci komórki.
Wcześniejsze badania nad rolą toksycznych form białka SOD1 w dużej mierze koncentrowały się na zmutowanych formach białka i były prowadzone głównie przy użyciu zwierzęcych i komórkowych modeli ALS.
To badanie, prowadzone przez zespół z University of Sydney’s Brain and Mind Center, pogłębia naszą wiedzę na temat przyczyn choroby neuronu ruchowego poprzez badanie tego nieprawidłowego białka w tkance pośmiertnej pacjentów z ALS.
„Po raz pierwszy pokazaliśmy, że mechanizmy chorobowe, o których od dawna zakładano, że występują w modelach zwierzęcych i komórkowych, są obecne u pacjentów z chorobą neuronów ruchowych” – mówi główny autor, dr Benjamin Trist z School of Medicine and Health’s Brain and Mind. Środek. .
„Jest to kamień milowy w naszym zrozumieniu stwardnienia zanikowego bocznego i choroby neuronu ruchowego w szerszym ujęciu”.
W ramach powiązanych eksperymentów profesor Double i jej zespół badają obecnie interakcje nieprawidłowego SOD1 z innymi powiązanymi z chorobą białkami w chorobie neuronu ruchowego. Ta praca jest w trakcie publikacji i zostanie opublikowana w Komunikacja Acta Neuropathologica.
O tych badaniach nad wiadomościami o chorobie neuronu ruchowego
autor: Biuro prasowe
źródło: Uniwersytet w Sydney
Kontakt: Biuro Prasowe – University of Sydney
obrazek: Obraz przypisywany jest Tristowi i in.
oryginalne wyszukiwanie: otwarty dostęp.
„Modulacja dojrzewania SOD1 i modulacja potranslacyjna w stwardnieniu zanikowym bocznym rdzenia kręgowegoNapisane przez Benjamina J. Trieste i in. mózg
Streszczenie
Modulacja dojrzewania SOD1 i modulacja potranslacyjna w stwardnieniu zanikowym bocznym rdzenia kręgowego
Ukośne samoorganizacja i toksyczność dzikiej i zmutowanej dysmutazy ponadtlenkowej 1 (SOD1) zostały szeroko zbadane. w silicoA w laboratoriumoraz w transgenicznych modelach zwierzęcych stwardnienia zanikowego bocznego (ALS). Jednak szczegółowe badanie białka w chorych tkankach pacjentów z ALS jest nadal rzadkie.
Zastosowaliśmy techniki histologiczne, biochemiczne i analityczne do modyfikacji profilu odkładania białka SOD1, lokalizacji subkomórkowej, dojrzewania i modyfikacji potranslacyjnej w pośmiertnych tkankach rdzenia kręgowego z przypadków ALS i kontroli. Tkankę rozcięto na brzuszną i grzbietową istotę szarą rdzenia kręgowego, aby ocenić specyficzność zmian w obszarach zwyrodnienia neuronów ruchowych.
Dostarczamy dowodów na błędną lokalizację i akumulację strukturalnie niedojrzałych i niedojrzałych konformerów SOD1 w neuronach ruchowych rdzenia kręgowego w SOD1– knagi i nie-SOD1Powiązane rodzinne przypadki ALS i sporadyczne przypadki ALS w porównaniu z kontrolnymi neuronami ruchowymi. Zmiany te łącznie powiązano z niestabilnością i brakiem równowagi w enzymatycznie aktywnych dimerach SOD1, a także zmianami w potranslacyjnych modyfikacjach SOD1 i białkami opiekuńczymi, które regulują dojrzewanie SOD1.
Nietypowe zmiany w białku SOD1 były w dużej mierze ograniczone do obszarów neurodegeneracji w przypadkach ALS i były wyraźnie rozróżniane wśród wszystkich postaci ALS od kontroli. Istotną niejednorodność w obecności tych zmian obserwowano również między przypadkami stwardnienia zanikowego bocznego.
Nasze dane pokazują, że różne formy proteinopatii SOD1 są wspólną cechą wszystkich form ALS i potwierdzają istnienie jednego lub więcej zbieżnych szlaków biochemicznych, które prowadzą do proteinopatii SOD1 w ALS. Większość z tych zmian jest specyficzna dla obszarów neurodegeneracji, a zatem mogą stanowić ważne cele dla rozwoju terapeutycznego.

„Podróżujący ninja. Rozrabiaka. Badacz bekonów. Ekspert od ekstremalnych alkoholi. Obrońca zombie.”